Ein Galvanisches Element, auch Galvanische Zelle genannt, ist eine Grundlage der Elektro-Chemie. Grob gesprochen entspricht es einer Batterie.
Chemischer Effekt[]
Hier eine Übersicht über die Wirkungsweise solch eines Galvanischen Elements. Als Beispiele werden Litium (Li), das unedelste Metall, und Silber (Ag) als ein klassisches Symbol für Edelmetalle angeführt.
Vorkenntnis: Edelmetalle[]
Edelmetalle sind allgemein definiert als Metalle, die nicht bei normalen Bedingungen mit Luftsauerstoff reagieren. Aber ob ein Metall edel ist, kann auch relativ sein: Wenn ein Metall edler oder unedler als ein anderes ist. Edler ist ein Metall mit höherem Standartelektronenpotential (später mehr dazu). So ist Gold edler als Blei und Zinn unedler als Silber.
Versuch mit dem Eisennagel[]
Zur Veranschaulichung kann man je einen Eisennagel (Fe) in drei verschiedene Salz-Lösungen geben: Silbernitrat (AgNO3), Eisensulfat (FeSO4) und Zinksulfat (ZnSO4) jeweils in Wasser.
Beobachtung[]
- Der Nagel wird mit einer silbrigen Schicht überzogen, die Lösung verfärbt sich leicht
- keine Reaktion
- ebenfalls keine Reaktion
Erklärung[]
- Das Eisen ist unedler als das Silber, das im Salz vorliegt. Es gibt Elektronen ab: Fe → Fe^2+ (+) 2 e- ; Die Silber-Ionen aus dem Salz nehmen hingegen Elektronen auf: 2 Ag+ (+) 2 e- → 2 Ag. Nun ist die Elektronenaufnahme als Redkution (Ag wird reduziert) und deren Abgabe als Oxidation (Fe wird oxidiert) definiert. Also liegt eine ReDox-Reaktion vor. Das entstandene elementare Silber lagert sich am Nagel ab und bildet einen silbrigen Überzug. Nun können die Eisen-Ionen noch mit den "zurückgelassenen" Nitrat-Ionen reagieren: Fe^2+ (+) 2 NO3 - ↔Fe(NO3)2
- Eisen reagiert nicht mit Eisen.
- Nun liegt das unedlere Metall als Ion vor. Also findet keine Reaktion statt.
Erkenntnis aus dem Versuch[]
Wenn ein Metall mit einer als Salz vorliegenden Form eines vergleichsweise Metalls reagiert, dann findet eine Elektronenübertragung statt.
Zu Anfang wurden Metalle als edel bezeichnet, wenn sie nicht mit Sauerstoff reagieren, also nicht oxidieren. Unedle wären dementsprechend oxidierende Metalle. Wenn man nun die bei der Versuchsbeschreibung erläuterte elektrochemische Definition von Oxidation heranzieht, behält dies seine entscheidende Bedeutung in der relativen Definition: Unedle Metalle werden oxidiert. So weit bleibt es also gleich. Edle Metalle werden nicht oxidiert, wenn überhaupt (also wenn sie als Ion in der Reaktion vorliegen), reduziert.
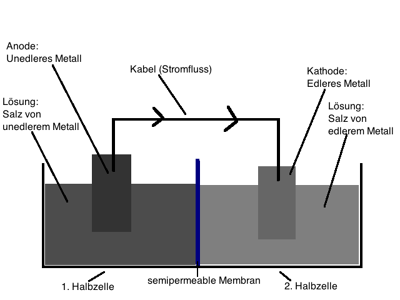
Aufbau eines Galvanischen Elements
Versuchsaufbau[]
- Ein großes Gefäß (also das Element), getrennt durch eine Semipermeable Membran, die nur Ionen, nicht aber Flüssigkeiten, und das Gefäß in zwei Halbzellen unterteilt
- 1. Halbzelle wird mit einer Lösung gefüllt, die ein Salz aus einem bestimmten Metall beinhaltet
- Hineingehangen/gehalten/... wird dieses Metall in elementarer Form
- 2. Halbzelle wird mit entsprechender Lösung und Metall gefüllt. Diesmal ist das Metall edler als in der anderen Halbzelle
- Ein Stromkabel verbindet die beiden elementaren Metallstücke
Beobachtung[]
- Strom fließt durch das Kabel von Halbzelle 1 zu Halbzelle 2
- Das unedlere Metall wird langsam kleiner, das edlere Größer
Erklärung[]
Als Beispiel wird das historische Experiment des Daniell-Elements gewählt: Das unedlere Metall ist Zink (Zn) und Kupfer (Cu). Dementsprechend sind die Salze in den Lösungen Zinksulfat (ZnSO4) und Kupfersulfat (CuSO4)
Das unedlere Metall, also hier Zink, ist leichter zu oxidieren: Zn -> Zn^2+ (+) 2 e- ; Die Zink-Ionen, die bei dieser Reaktion entstehen, wandern in die Lösung, die Elektronen bleiben im Zink. Wenn überhaupt tritt dies beim Kupfer geringfügig auf. Das Zink wird negativer als das Kupfer, da ein Elektronenüberfluss besteht. Das Ladungsgefälle sorgt für einen Elektronen-Fluss, also elektrischen Strom. Wird nun ein Widerstand angeschlossen wird, wird nicht nur ein Kurzschluss vermieden, sondern auch evtl eine Wirkung erziehlt (z.B. eine Lampe zum Glühen gebracht).
Das Kupfer-Ion (Cu^2+) aus dem Sulfat reagiert mit den eintreffenden Elektronen: Cu^2+ (+) 2 e- -> Cu ; Das Kupfer wird als Element an das bereits elementare Kupfer angelagert. Das negative Sulfat-Ion (SO4^2-) verbleibt zunächst in der Lösung, würde allerdings, ähnlich wie die positiven Zink-Ionen, das Ladungsgefälle abschwächen und bald beenden.
Allerdings können die Ionen durch die Membran in die andere Halbzelle wendern, zumal die Lösungen untereinander auch ein Ladungsgefälle aufweisen.